
Què volem saber?
-
Elements de la taula periòdica?
-
Què forma els elements? I la matèria?
-
Què és un àtom?
-
Com es combinen els àtoms? Què formen al combinar-se?
L'àtom
Què és l’àtom? L’àtom és la unitat bàsica de tota la matèria, y el component dels elements químics de la taula periòdica.
Com diferenciem els àtoms? Els àtom els diferenciem en funció del nombre de partícules que tenen.
Models atòmics
A l’antiga Grècia Demòcrit, va dir que la matèria estava formada per unes partícules indivisibles, i les va anomenar àtoms que en grec vol dir indivisibles.
Molts anys després al 1897 Joseph J. Thomson va deduir que l’àtom devia ser una esfera de matèria carregada positivament, amb electrons al seu interior (partícules amb càrrega negativa).
Ernest Rutherford al 1911 en canvi va dir que els àtoms en realitat estaven buits i que al centre hi havia un nucli, per tant el àtom estava format per un nucli carregat positivament, amb una mena d’escorça d’electrons girant al voltant de manera indefinida. Per descobrir-ho va agafar una làmina d’or i la va atravessar amb partícules alfa al veure que gairabé tots els rajos passaven va descobrir que no eren massisos els àtoms.
Dos anys més tard Niels Bohr, aprenent de Rutherford no desmentia la seva teoria, simplement la complementava dient que els electrons orbitaven al voltant del nucli en unes capes ben definides d’electrons (òrbites, que són nivells energètics al voltant del nucli d’un àtom on es situen els electrons) això vol dir que no totes les òrbites son possibles només un nombre finit, i en funció de si guanyen o perden energia, pugen o baixen de nivell.
Actualment el model ha estat desenvolupat per un grup de científics: Schrödinger, De Boglie, Heisenberg, Einstein... En realitat el model de Bohr és perfectament aplicable a l’àtom d’hidrogen però no en els altres. Ara ja no parlem de capes sinó de zones on la probabilitat de trobar electrons és molt elevada (orbitals) ja que es mouen en un zona determinada (lòbuls x,y,z)
Partícules subatómiques
Fins fa poc es creia que els àtoms estaven formats per 3 partícules subatòmiques, els protons els neutrons i els electrons. Però en realitat n’hi ha més. A continuació les dades de les 3 partícules més comunes
-
Protons (p): La càrrega elèctrica del protó és de 1,6 × 10-19 C, es situa al centre de l’àtom, per això juntament amb el neutró, és anomenat nucleó. El seu pes es 1837 vegades més gran que el de l’electró. La seva massa és 1,67×10−27 kg. I el va descobrir Ernest Rutherford.
-
Neutrons (n): No té càrrega elèctrica, ja que és neutre. Es troba al centre de l’àtom La seva massa és de 1.67x10-27kg. Va ser descobert per James Chadwick.
-
Electrons (e-): La seva càrrega és −1.6×10−19 La seva massa és de 9,1×10−31 kg Es troben al voltant del nucli de l’àtom. Descoberts per Thomson.
Nombre atòmic: És igual al nombre de protons
Nombre màssic: Protons + Neutrons. Si restem el nombre atòmic menys el màssic és igual als neutrons
Ions i Isòtops
Ions: Hi ha dos tipus de ions, si fan disminuir el nombre d’electrons són positius (cations/X+n), i si els augmenten són negatius (anions/X-n)
Isòtops: D’un mateix element modifiquem el nombre neutrons, i per tant, canvia el nombre màssic (A)
Configuració electrònica
Segons Bohr, hi ha diferents nivells d’energia, i cada nivell correspon a una òrbita (n). Com menys energia tenen aquests nivells més estables són. Cada nivell té un nombre màxim d’electrons que pot contenir. (Nivell 1-2 e-, 2-8 e-, 3-18 e-, 4-32 e-...). Les propietats químiques dels elements depenen de la configuració electrònica
Principi d'Aufbau: Els electrons entren als orbitals en ordre d'energia creixent.
Els electrons en un suborbital tenen tendència a estar desaparellats.
Diagrama de Möller:
1S
2S 2P
3S 3P 3d
4S 4P 4d 4f
5S 5P 5d 5f...
6S 6P 6d 6f...
La taula periòdica (TP) i la seva evolució
Des de l’antiguitat fins a l’Edat mitjana hi havia poc més de 12 elements descoberts, i a partir del segle XVIII es van descobrir molts gasos i metalls
Al 1789 Antoine Lavoiser va elaborar la primera llista amb 33 substàncies simples
Al 1817 Döbereiner va trobar similituds en grups de 3 elements (triades)
Al 1862 Chancourtois va ser el primer en utilitzar massa atòmica per classificar elements, va observar similituds vertical en disposar els elements coneguts sobre una corba helicoïdal
Al 1865 Newlands va inventar la llei de les octaves, observant que hi havia una variació gradual al disposar els elements en files de set, dient que el vuitè tenia propietats semblant al primer.
1869, Meyer i Mendeleiev, van arribar de manera independent i simultània a conclusions semblants, analitzant les propietats físiques i químiques dels elements. Va ordenar els elements en files i columnes, deixant buits, per elements que encara no s’havien descobert.
Al 1912 Mosoley, va establir la llei periòdica: “Si els elements s’ordenen en ordre creixent de nombre atòmic, s’observa una variació periòdica e les propietats físiques i químiques”.
Grups de la TP
1: Alcalins
2: Alcalinoterris
3-12: Elements de Transició
13: Grup del bor
14: Grup del carboni
15: Grup del nitrogen
16: Grup del oxigen
17: Halògens
18: Gasos nobles
Estats d'oxidació
L'estat d'oxidació o nombre d'oxidació es defineix com la suma de càrregues positives i negatives d'un àtom, la qual cosa indirectament indica el nombre d'electrons que l'àtom ha acceptat o cedit.
Metalls i no metalls
Metalls: Sòlids, tendeixen a perdre electrons per assemblar-se als gasos nobles. Estats d’oxidació +, Els cations poden tenir més d’un estat d’oxidació o valència. Són bons conductor de la calor i la electricitat. A temperatura ambient són sòlids (menys el mercuri. Brillen. Són mal·leables, és a dir es poden convertir en làmines. Són dúctils
No metalls: Gasos o líquids, tendeixen a guanyar electrons, per assemblar-se als gasos nobles. La n vol dir no metall. Poden formar tant cations com anions, per tant estats d’oxidació + i -. Els negatius 1 valor, i els positius 1 o més. No són dúctils. No són mal·leables. No brillen. Solen ser menys densos que l’aigua
Enllaços
Els elements de la Taula Periòdica, s'enllacen entre ells, per poder tenir 8 electrons a la capa de valència. Aquest procés el fan donant i reben electrons, o compartint-los
Nomenclatura tradicional
Elements amb 2 valències:
Fe: +2 (-ós) / +3 (-ic)
Elements amb 4 valències:
Cl: +1 (hipo –os) / +3 (-os) / +5 (-ic) / +7 (per –ic)
Podem simplificar compostos si les seves valències es poden dividir. Exemple MgO (No pot ser Mg2O2)
Canvis físics i químics
Canvi físic: Canvien propietats de les substàncies, però manté la seva naturalesa. Podem tornar a la substància inicial mitjançant mètodes físics.
Canvi químic: Hi ha un canvi de la naturalesa de la substància. Podem tornar a la substància inicial mitjançant mètodes químics. Una reacció química es un canvi químic.
Activitat: La he liado parda
Quins són els reactius i quins els productes? Àcid clorhídric (HCl) + Oxorbit d’hidrogen/ Àcid hipoclorit (HClO) = Gas groc (Cl2) + Aigua (H2O)
En quin estat d’agregació es troben tots els components? En estat líquid, però un cop feta la reacció, és converteix en gas
Tipus de reaccions
Síntesis (formació): Dos o més compostos dónen lloc a un de sol
Descomposició: Un compost es divideix dos o més
Desplaçament (formació): Un dels elements del compost, s'ajunta amb l'altre element, separant-se del que estava ajuntat
Neutralitació: Un compost bàsic es barreja amb àcid per formar sal i aigua
Combustió: Un compost amb carboni, reacciona amb l'oxigen per formar, diòxid de carboni i aigua
Classificació de reaccions
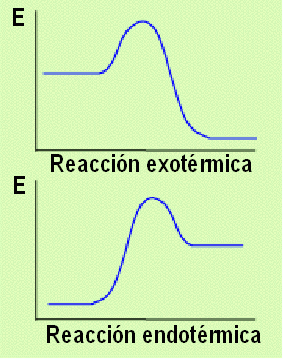
En funció de si la reacció desprèn calor (Q) o n'absorbeix mentre s'efectua, classifiquem les reaccions en:
Reaccions endotèrmiques (Absorbeix calor): A+B+Q = C
Reaccions exotèrmiques (Desprèn calor): A+B = C+Q
El mol
És la unitat de mesura del S.I, de quantitat de substància, per calcular la massa en la vida quotidiana, utilitzem el kilogram, però en química, al utilitzar quantitats més petites fem servir el gram o el mol. Exactament un mol de qualsevol substància equival a 6,023 . 10^23 de aquella substància.
Exemple: Com calculem quant són 5 mols de àcid clorhídric? Primer hem de saber la massa atòmica de cada element (H=1) (Cl=35,5), després calculem la massa mol·lecular, que no és més que la suma de les masses atòmiques Mr(HCl) = 36,5 (En cas de que hi hagi més de un àtom del mateix element com l’aigua, H2O, es multiplica pel nombre de àtoms que tinguem). I finalment el factor de conversió és: 5 mols de HCl · 36,5 g de HCl / 1 mol de HCl = És igual a 182,5 grams de HCl
Teoria de les col·lisions
Aquesta teoria ens diu que perquè dos compostos reaccionin, necessiten tenir la energia suficient per trencar els enllaços i formar-ne nous, i tenir la orientació adequada. Només llavors el xoc serà eficaç.


Thomson

Rutherford

Bohr

Actual











Llei dels gasos i gasos ideals
És una propietat de les reaccions. Les magnituds que es fan servir són:
-
la pressió (P): atmosferes (atml) mil·límetres de mercuri (mmHg), bars, pascals (Pa). RELACIONS: 1 atm = 760 mmHg / 1 atm = 1,01 · 105 Pa
-
la temperatura (T): ºC, Kelvin (K). 0 ºC = 273,15 K
-
el volum (V): Litres (L), i decímetres cúbics (dm3)
El que fan les lleis dels gasos, és mantenir una d’aquestes tres magnituds i les altres dues varien.
Charles: V= Constant P/T = Constant
Gay-Lussac P= Constant V/T = Constant
Boyle: T= Constant P.V = Constant
En els gasos ideals, la R és la constant dels gasos ideals, i és 8,31, i la equació és: R = atm.dm3 / mol.K
Condicions estàndard (c.e): P= 1atm i T= 25ºC = 298,15 K
Condicions normals (c.n) P= 1atm i T= 0ºC = 273, 15 K
La equació que fem servir és P.V=n.R.T i en funció de les magnituds que sapiguem modifiquem la equació per a saber les altres, per exemple si volguessim saber el volum la equació passaria a ser V=n.R.T / P
Activitats de reaccions
1. Explica quina és la diferència entre una transformació física i una transformació química. Posa dos exemples de cadascuna En una transformació física, pot canviar la forma de la substància, però no en canvia la naturalesa (L’aigua congelada, Trencar un llistó de fusta). En canvi en una transformació química, el producte de la reacció és una substància diferent a les inicials amb propietats diferents (Cremar un llumí, La respiració)
2. Indica si els processos següents són transformacions físiques o químiques:
a) Escalfar un líquid fins a elevar-ne la temperatura de 21 a 42 ºC. Físic
b) Fondre una peça de bronze. Físic
c) Cremar fusta en una xemeneia. Químic
3. Donada la reacció Nitrogen (gas) + Hidrogen (gas) = Amoníac (gas)
a) Escriu l’equació química ajustada corresponent. N2 + 3H2 = NH3
b) Explica per què cal ajustar les equacions químiques. Perquè segons la llei de conservació de la massa, en una reacció els àtoms no es creen ni es destrueixen.
4. Quina de les equacions químiques següents correspon a la reacció ajustada de combustió de metà? CH4 (g) + 2O2 (g) = CO2 (g) + 2H2O (g)
5. Assenyala quina de les equacions químiques següents no està ben ajustada.
Hg + S = Hg2S
6. Ajusta les equacions químiques següents
a) 2CO + O2 = 2CO2
b) 2HCl + Ca(OH)2 = CaCl2 + 2H2O
7. Calcula el nombre de mols existent en 315 grams de HNO3. Masses atòmiques: H=1, N=14, O=16
315 g de HNO3 · 1 mol / 63 g de HNO3 = 5 mols de HNO3
8. Calcula els grams que són 1,5 mols de H3PO4. Masses atòmiques: H=1, P=31, O=16,
1,5 mols de H3PO4 · 98 g de H3PO4 / 1 mol de H3PO4 = 147 g de H3PO4
9. Calcula el nombre de mols i molècules que hi ha en 308 grams de CCl4. Masses atòmiques: C=12, Cl=35,5
308 g de CCl4 · 1 mol de CCl4 / 154 g de CCl4 = 2 mols de CCl4
Molècules: 2 · 6,023 · 1023 = 12,046 · 1023 Molècules
